Was ist FRET?
Der Förster-Resonanzenergietransfer (FRET) beschreibt ein physikalisches Phänomen des nicht strahlenden Energietransfers auf der Grundlage einer Dipol-Dipol-Kopplung, das von einem Fluorophor im angeregten Zustand (dem Donor) zu einem Fluorophor im Grundzustand (dem Akzeptor) auftreten kann (Abb. 1). FRET wird durch das Auftreten einer sensibilisierten Fluoreszenz im Akzeptor und durch eine Abnahme (Löschung) der Donorfluoreszenz nachgewiesen.
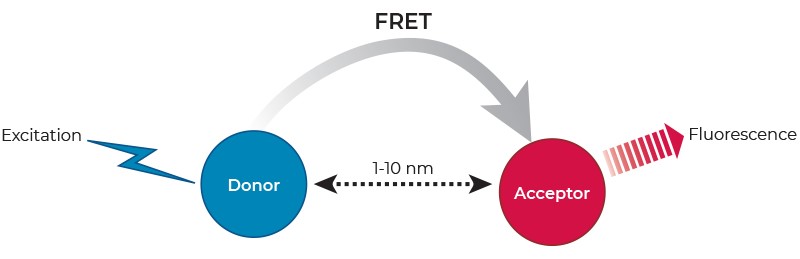
FRET tritt nur auf, wenn das Donorfluoreszenzemissionsspektrum mit dem Akzeptoranregungsspektrum überlappt, wenn die relativen Dipolorientierungen von Donor zu Akzeptor ungefähr parallel sind und wenn sich Donor und Akzeptor in unmittelbarer Nähe befinden (typischerweise 1 bis 10 nm). Letzteres hat zur weit verbreiteten Anwendung von FRET in der biomedizinischen Forschung zur Untersuchung molekularer Wechselwirkungen sowie zur Messung von Abständen im molekularen Maßstab geführt.
Da die Energieübertragung nur erfolgt, wenn sich Donor und Akzeptor nahe genug beieinander befinden, sind FRET-basierte Assays homogen. Das heißt, sie erfordern keine Wasch- oder Trennschritte, um entfernte Donor- und Akzeptorpartner zu entfernen. Die Leistung herkömmlicher FRET-Assays unter Verwendung herkömmlicher Fluorophore wird jedoch häufig durch die Anfälligkeit herkömmlicher Fluorophore für Photobleichung und durch Streulicht und hohe Hintergrundfluoreszenz von Probenkomponenten (z. B. Zelltrümmern, Puffern, Testverbindungen und Mikroplatten) beeinträchtigt. Dies macht FRET-Signal-Hintergrund-Pegel (S/B) für viele Anwendungen nicht zufriedenstellend.

 English
English


