Das Kultivieren von Zellen außerhalb ihrer natürlichen Umgebung in einem Labor unter kontrollierten Bedingungen ist unentbehrlich für die wissenschaftliche Forschung. Vor allem 3D-Kulturen spiegeln in-vivo-Zustände hinsichtlich Zellmorphologie, Wechselwirkungen und gewebespezifischer Architektur, sind also in Summe relativ nahe am nativen Gewebe.
Der Nachteil: 3D-Methoden zeigen derzeit oft noch einen niedrigen experimentellen Durchsatz, unklare Standards und oft schlechte Reproduzierbarkeit. Zusätzlich ist eine gründliche Validierung dieser Modelle im Vergleich zu Standard-2D-Assays und Tiermodellen erforderlich, bevor sie großflächig angenommen werden können. Dennoch sind 3D-Modelle die Zukunft. Das Wissen darüber wächst täglich, und durch Fortschritte im Bereich 3D-Druck (bald verfügbar: Corning Matribot Bioprinter) und Technologieplattformen wird es künftig einfacher, schneller und billiger werden, diese Plattformen für großformatige Protokolle mit hohem Durchsatz einzubauen. Aber was können 3D-Modelle schon jetzt leisten? Am gebräuchlichsten sind dabei die Begriffe Sphäroid und Organoid sowie 3D-Gewebe-Modelle.
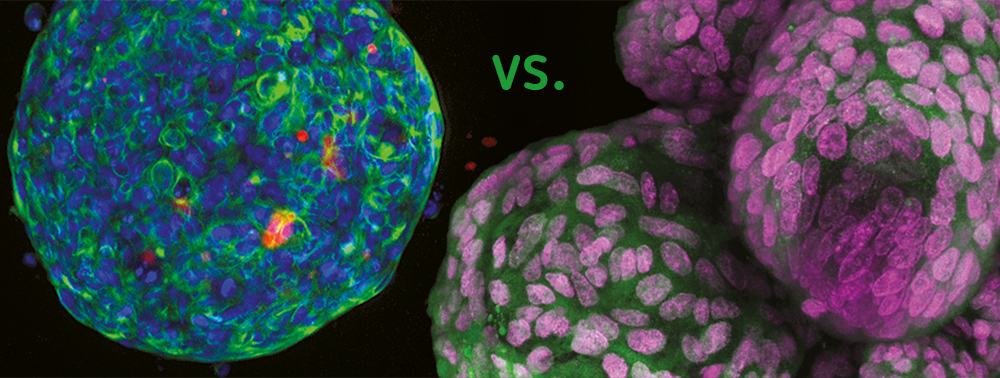
Sphäroid – erster Schritt

Der Begriff „Sphäroid“ wurde erstmals in den 1970er Jahren von R.M. Sutherland geprägt, als dieser beobachtet, dass V79-Lungenzellen von chinesischen Hamstern in Suspension in Spinner-Flaschen kugelförmige Zellaggregate formten. Seitdem wurden Sphäroide aus vielen Primären-Zelltypen und Zelllinien auf vielfältige Weise hergestellt, z.B. mittels Low-Cell-Attachment-Platten. Sehr häufig werden Sphäroide in der Krebsforschung eingesetzt, wo Tumorzellen das klassische mehrzellige Tumor-Sphäroid MCTS bilden. Es besteht aus einer externen proliferierenden Region und einer internen Ruhezone, verursacht durch den Nährstoffgradienten und die Sauerstoffdiffusion. Die Zellarchitektur innerhalb des MCTS simuliert die in-vivo-Zustände bezüglich Zellmorphologie, Proliferation, Oxygenierung, Nährstoff-Aufnahme, Abfallausscheidung und Arzneimittelaufnahme. Deshalb ist das MCTS Modell mittlerweile eines der am weitesten verbreiteten vorklinischen Screening-Tools für mögliche neue Krebsmedikamente.
Organoid – der Schritt in Richtung Gewebe
Organoid ist ein allgemeiner Begriff, der 3D-Strukturen aus Stammzellen oder gewachsene Zell-Strukturen als Organvorläufer meint. Diese setzen sich aus sich selbst organisierenden organspezifischen Zellen zusammen, sind räumlich begrenzt und scheinen Funktionen von Geweben oder Organen zu haben.
Organoide können aus adultem Gewebe stammen oder aus pluripotenten Stammzellen. Ähnlich wie in-vivo-Organe enthalten Organoide mehrere Zelltypen, die in Strukturen organisiert sind, die einem Organ ähneln und auch einige der Organfunktionen zeigen. Modellsysteme zu Gehirn, Leber, Thymusdrüse, Schilddrüse, Lunge, Bauchspeicheldrüse, Darm und Herz konnten schon hergestellt werden. Diese Modelle werden z.B. für Arzneimittelentdeckung/-screening und Toxizitätstests verwendet. Wichtig ist auch die Anwesenheit von biologischen oder synthetischen Matrizen. Die Interaktion zwischen den Zellen und der extrazellulären Matrix (ECM) ist essenziell für Überleben, Proliferation, Differenzierung und Migration. Das ECM bietet auch eine Umgebung, in der sich Zellen bewegen und dreidimensional wachsen können. Sphäroid-Kulturen sind für ihre Bildung weniger auf Matrizen angewiesen.
3D-Gewebe-Modellsysteme auf Chips

3D-Kulturen wie Sphäroide und Organoide sind eine markante Verbesserung gegenüber zweidimensionalen Monolayer-Kulturen, sie können aber immer noch nicht die vollständige Architektur von Geweben, einschließlich Gefäßsystemen und interstitiellem Flüssigkeitsfluss imitieren. Die „Organ-on-a-Chip“ (OOC)-Technologie wird möglicherweise in der Lage sein, einige dieser Einschränkungen zu beheben. Zellen werden in kontinuierlich perfundierten, mikrometergroßen Kammern gezüchtet. Dabei entstehen physiologisch relevante Niveaus von Scherkräften und vaskuläre Ernährung, Gas- und Abfalltransport, ähnlich wie in-vivo-Gewebe. Das erste derartige System war der „Lung-on-a-Chip“, entworfen vom Wyss Institute an der Harvard University. Untersucht wurde dabei die Wirkung einer bakteriellen Infektion auf die Lungenfunktion. Seitdem wurden Modellsysteme für Herz, Niere, Arterien, Knochen, Knorpel, Haut und andere entwickelt.
OOCs und ihre Ähnlichkeit zu nativen Geweben machen sie zu hervorragenden Werkzeugen, um organspezifisch biomechanische und biochemische Mechanismen aufzuklären, und sie finden Verwendung im Drug-Screening. Diese Plattform hat das Potenzial Kosten zu senken, Tierversuche zu ersetzen und die Arzneimittel-Forschung zu optimieren. Letztlich ist das Ziel ein „Human-on-a-Chip“ System, bei dem mehrere Organe verbunden sind, um die „Ganzkörper“-Antwort zu beurteilen und Zellkulturen und Tierversuche zu ersetzen. Die „Organ-on-a-Chip“-Technologie ist sehr vielversprechend. Der Weg ist aber noch sehr lange, zu komplex sind echte Gewebe. Es bedarf noch viel Forschung auf diesem Gebiet.
Alles für die 3D-Zellkultur
Szabo-Scandic beschäftigt sich seit vielen Jahren mit dem Thema Zellkultur und bietet das gesamte Verbrauchsmaterial an, damit Ihre 3D-Zellkultur gelingt – von Zelllinien und Primärzellen über Medien und Seren bis hin zu Schalen, Flaschen und Mikrotiterplatten, von Puffer und Markern bis hin zu Cell Counter und Bio-Assays. Die Erfahrung zeigt: Für die erfolgreiche Zellkultur braucht es Geduld und eine valide Ausrüstung.
Weitere interessante Artikel:

 English
English


