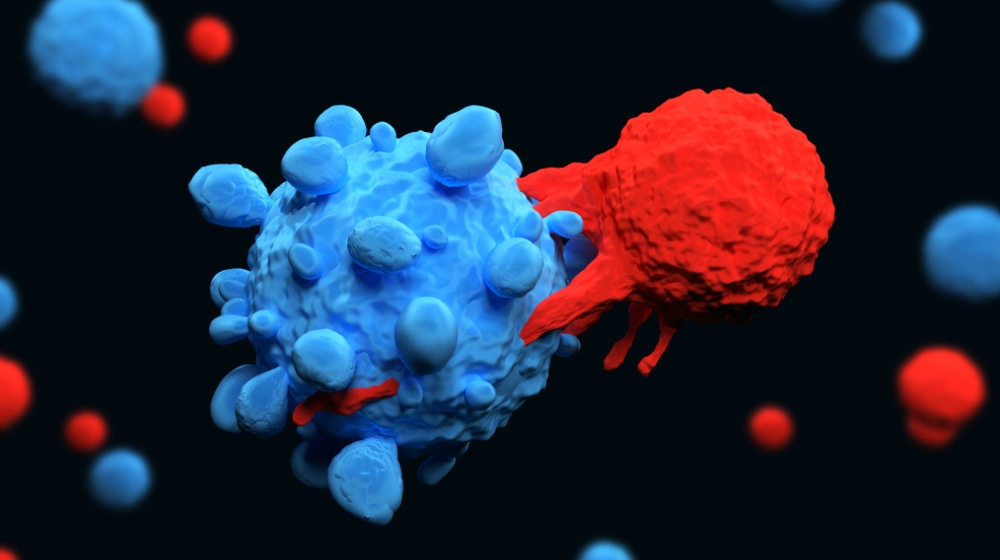
Chimere Antigen Rezeptor (CAR) T-Zellen etablierten sich in den letzten Jahren als einer der vielversprechendsten Ansätze der Tumortherapie. Die gentechnische Veränderung von körpereigenen Immunzellen ist die Grundlage dieses neuen Ansatzes und bereits mehrere Therapien wurden von der FDA und EMA zugelassen. Der Ansatz zeigt das Potential, das im kombinierten Einsatz von Zelltherapie und individualisierter Medizin schlummert. Doch wie gelingt es CAR-T-Zellen herzustellen und als lebende Medikamente gegen Krebs einzusetzen?
Die Vorgehensweise bei der Herstellung von CAR-T-Zellen
1. Isolation der Zellen
Alles beginnt im Blut des Patienten. Mittels Leukapherese wird diesem das Blut entnommen um periphere Stammzellen (PBMC) heraus zu filtern. Das restliche Blut wird dem Patienten wieder zugeführt.
Research Donors bietet frische menschliche Blutprodukte wie Leukopacks, PBMCs, Vollblut oder Buffy Coats von gesunden Spendern für die Forschung an.
 2. T-Zell-Expansion
2. T-Zell-Expansion
Die isolierten und aufgereinigten Zellen werden anschließend in Kultur gebracht und mit cytokine interleukin 2 (IL-2) und anti-CD3 stimuliert, um die Proliferation von T-Zellen zu begünstigen.
Für die Umsetzung im Labor haben wir Consumables von Corning und Medien sowie Seren von Lonza und Corning im Sortiment.
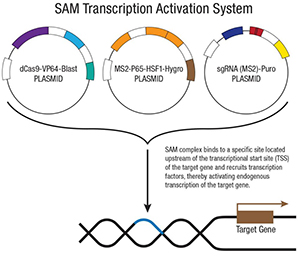
3. T-Zell-Transduction
Den gewonnen T-Zellen des Patienten wird anschließend durch retrovirale Vektoren oder mittels CRISPR/Cas9 ein CAR (chimeric antigen receptor) codierendes Gen eingesetzt. Die Art an CAR ist abhängig von der jeweiligen Tumorerkrankung des Patienten. Im Fall von Leukämie zeigte sich beispielsweise CAR gegen CD19, einem Protein das von normalen B Zellen wie auch von cancerogenen B-Zell Lymphomen exprimiert wird, als effektives Ziel-Antigen. Der Umstand, dass im Grunde jedes Tumor-assoziierte Antigen als Ziel für die transduzierten T-Zellen dienen kann und gleich mehrere Antigene als Ziele gewählt werden können um das Risiko von Immunevasion zu reduzieren, machen CAR-T Zelltherapie zu einem vielversprechenden Ansatz gegen eine breite Front an Krebserkrankungen.
Die CRISPR/Cas9 Produkte von Santa Cruz stellen ein wertvolles Werkzeug bei der Geneditierung dar und werden in der Therapie noch verstärkter eingesetzt.
4. Infusion der T-Zellen
Nachdem die zirkulierende Leukozytenzahl des Patienten mittels Chemotherapie gesenkt wurde, werden die transduzierten T-Zellen wieder dem Blut zugeführt. Der Therapieerfolg bei Blutkrebserkrankungen ist zwar sehr hoch (bis zu 90%), doch bestehen nach wie vor große Hürden. Teils starke Nebenwirkungen & erhöhte Mortalität nach Therapieende durch erneutes Auftauchen von Leukämie und hohe Kosten zeigen derzeit noch die Grenzen der CAR-T-Zell-Therapie auf.
Nichtsdestotrotz hält der Therapieansatz viele Chancen zur Weiterentwicklung. Seien es neue Konzepte um auch feste Tumore zu bekämpfen, weitere Antigene als Ziele für CAR, Kontrollmechanismen, die das gezielte Ein- und Ausschalten der gentechnisch veränderten T-Zellen ermöglichen oder gar in vivo CAR-T-Zell-Herstellung: Bei allen Vor- und Nachteilen fehlt es jedenfalls nicht an einer Fülle an Möglichkeiten zur Weiterentwicklung dieser jungen Therapie.

 English
English