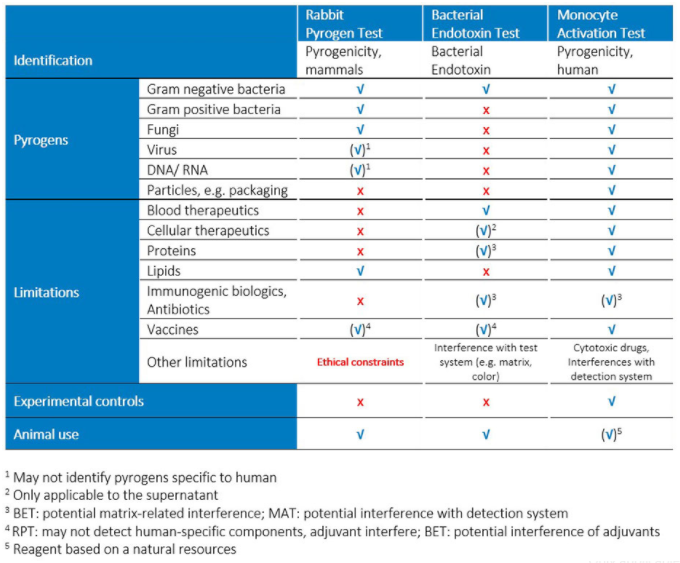
Tierschutzorganisationen fordern schon lange ein Ende von Pyrogentests an Kaninchen (RPT) - mit Erfolg. Bis 2026 sollen die verpflichtenden Pyrogentests nur noch tierversuchsfrei durchgeführt werden. Das hat die die europäische Arzneibuch-Kommission kürzlich im Europäischen Arzneibuch (Ph. Eur.) festgelegt. Da Pyrogene in Medikamenten lebensbedrohliche, systemische Reaktionen bei Patient:innen auslösen können, ist es essentiell, nachhaltige Lösungen für die Qualität und Sicherheit der Medikamente zu finden und Analysemethoden weiterzuentwickeln.
 Seit den 1990er Jahren gibt es die Möglichkeit, Pyrogene auf Basis humaner Zellen mit Zellkulturmethoden zu testen. Dieser sogenannte Monozyten Aktivierungstest (MAT) wurde 2010 als Alternative zum Kaninchentest (rabbit pyrogen test, RPT) in das Europäische Arzneibuch (Ph. Eur. 2.6.30) aufgenommen. Zwar muss der MAT produktspezifisch validiert und an jede Arzneimittelformulierung angepasst werden. Allerdings hat diese Methode gegenüber den bisher üblichen Kompendialmethoden für Pyrogentests – Kaninchen Pyrogentest (RPT) und bakterieller Endotoxintest (BET) – entscheidende Vorteile hinsichtlich der Einsatzmöglichkeiten und des Entwicklungspotentials.
Seit den 1990er Jahren gibt es die Möglichkeit, Pyrogene auf Basis humaner Zellen mit Zellkulturmethoden zu testen. Dieser sogenannte Monozyten Aktivierungstest (MAT) wurde 2010 als Alternative zum Kaninchentest (rabbit pyrogen test, RPT) in das Europäische Arzneibuch (Ph. Eur. 2.6.30) aufgenommen. Zwar muss der MAT produktspezifisch validiert und an jede Arzneimittelformulierung angepasst werden. Allerdings hat diese Methode gegenüber den bisher üblichen Kompendialmethoden für Pyrogentests – Kaninchen Pyrogentest (RPT) und bakterieller Endotoxintest (BET) – entscheidende Vorteile hinsichtlich der Einsatzmöglichkeiten und des Entwicklungspotentials.
Nachhaltige Pyrogen-Tests mit dem PyroCellTM Monozyten-Aktivierungstest
Ein entscheidender Schritt Richtung Tierversuchsverzicht ist das PyroCellTM Monozyten-Aktivierungstest (MAT) System. Das PyroCellTM Testkit von Lonza identifiziert zuverlässig auch geringe Spuren aller Endotoxin- und Nicht-Endotoxin-Pyrogenen (NEP), lässt sich einfach auf einer Mikrotiterplatte durchführen und gewährleistet Produktsicherheit und Konformität.
Vorteile des PyroCellTM Monozyten-Aktivierungstestsystems
- Patientensicherheit - Nachweis des gesamten Spektrums an Pyrogenen (Endotoxin- und Nicht-Endotoxin-Pyrogene) in einem Test
- Keine Versuchstiere - von den Regulierungsbehörden als Ersatz für den Kaninchen-Pyrogentest anerkannt
- Humanspezifisch - primäre menschliche Zellen imitieren die angeborene menschliche Reaktion auf Pyrogene
- Flexibel - sichere Prüfung traditioneller Pharmazeutika und moderner Biologika
- Empfindlich - Nachweisgrenze (LOD) ≤ 0,02 EU/mL
- Standardisiert - robuste Anwendungs- und Testkontrollen mit hoher Empfindlichkeit für zuverlässige Ergebnisse
PyroCellTM Monozyten-Aktivierungstest (MAT) Assay-Prinzip
Das PyroCellTM MAT-System ist ein optimierter Reagenzienkit für den empfindlichen Nachweis von Pyrogenen in pharmazeutischen Präparaten. Das Kit besteht aus einer Ampulle kryokonservierter mononuklearen Zellen aus dem peripherem Blut (PBMCs) und einem optimierten MAT-Kulturmediumzusatz. Das PyroCellTM MAT-Kit wurde mit dem humanen IL-6-ELISA-Kit von Pelikine validiert.
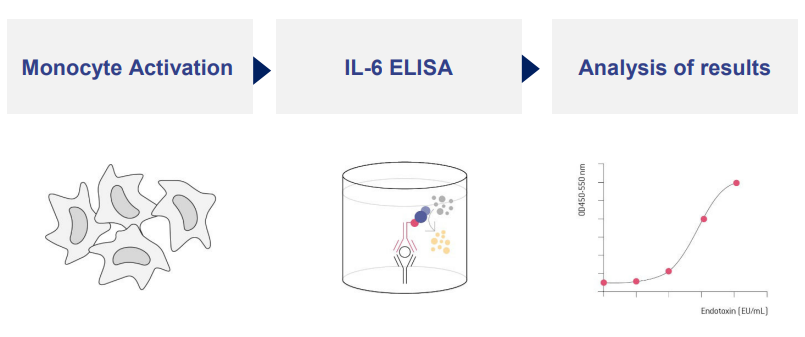
Der PyroCellTM MAT-Test misst die Reaktion des menschlichen Immunsystems. Monozyten, die Schlüsselzellen der angeborenen Immunität, reagieren auf die Anwesenheit von Pyrogenen (Endotoxine und Nicht-Endotoxin-Pyrogene) mit der Sekretion von pro-inflammatorischen Zytokinen, die mit einem ELISA-Assay quantifiziert werden.
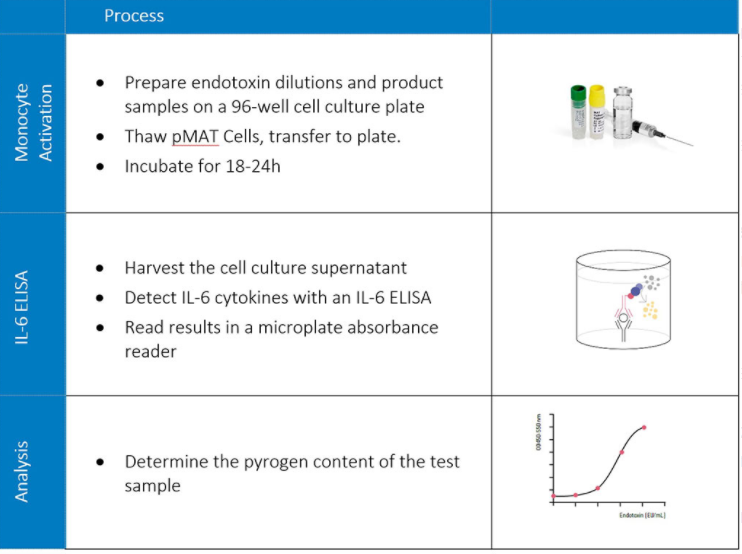 Am ersten Tag des Experiments werden die pMAT-Zellen aufgetaut und mit dem Produkt oder den Testproben in einer Zellkultur über Nacht (18-24 Stunden) bei 37°C in einem Inkubator inkubiert. Am folgenden Tag werden die Zellkulturüberstände abgenommen und das von humanen Monozyten freigesetzte Zytokin Interleukin-6 (IL-6) mit dem humanen IL-6-ELISA-Kit PeliKine nachgewiesen. Das Vorhandensein von IL-6 wird in einem Absorptionslesegerät als optische Dichte (OD) gemessen. Unter Verwendung von Referenz-Endotoxinverdünnungen werden die OD-Werte schließlich in Endotoxin-Äquivalenzeinheiten (EEU/mL) umgerechnet.
Am ersten Tag des Experiments werden die pMAT-Zellen aufgetaut und mit dem Produkt oder den Testproben in einer Zellkultur über Nacht (18-24 Stunden) bei 37°C in einem Inkubator inkubiert. Am folgenden Tag werden die Zellkulturüberstände abgenommen und das von humanen Monozyten freigesetzte Zytokin Interleukin-6 (IL-6) mit dem humanen IL-6-ELISA-Kit PeliKine nachgewiesen. Das Vorhandensein von IL-6 wird in einem Absorptionslesegerät als optische Dichte (OD) gemessen. Unter Verwendung von Referenz-Endotoxinverdünnungen werden die OD-Werte schließlich in Endotoxin-Äquivalenzeinheiten (EEU/mL) umgerechnet.
Einsatzmöglichkeiten des Monozyten-Aktivierungstests (MAT)
Die Früherkennung von Pyrogenität ist ein entscheidender Bestandteil der Qualitätskontrolle und eine wichtige Sicherheitsvorkehrung, um Patient:innen Medikamentensicherheit zu garantieren. In einem parenteralen Medikament können pyrogene Komponenten von Mikroorganismen, z.B. Bakterien, Viren und Pilzen, stammen. Aber auch nicht-organische Kontaminationen, wie Chemikalien, Metallverbindungen in Elastomeren, Gummiabrieb, etc., sind potentielle Gefahrenquellen und können beim Menschen Entzündungsreaktionen auslösen. Als In-vitro-Test bietet der PyroCellTM MAT-Test die perfekte Lösung für Produkte, die sich bei bakteriellen Standard-Endotoxin-Tests als problematisch erwiesen haben.

 English
English